[7월] [생화학] 암과 맞설 새로운 무기 - 죽음의 입맞춤
여러분들은 화학이라는 단어를 들었을 때 무슨 이미지가 떠오르시나요?
혹시... 미드 《브레이킹 배드》를 떠올리신 건... 아니겠죠....? ㅎㅎ...
물론 그 드라마의 주인공도 화학자이긴 하지만,
화학자가 그런 불법적이고(?) 요상한(?) 일만을 하는 것은 당연히 아닙니다!
화학이라는 여러분들의 생각보다 훨씬 더! 다양한 세부 분야들이 존재하고
그만큼 다양한 주제의 연구들이 진행되고 있는데요!
이번 한국화학연구원 제2기 케미러브 서포터즈 활동을 통해
여러분들께 한국화학연구원의 최신 연구 성과들을 소개해드림과 동시에
다양한 화학 분야들 역시도 소개해드릴까 합니다!
7월에 소개해드릴 화학 분야는 생화학 입니다!
최근 생화학 분야에서 핫!한 연구 주제인 '프로탁' 신약과
한국화학연구원의 프로탁 관련 연구 성과를 통해
이 분야에 대해 자세히 알아보도록 할까요??

▶ ‘알파고(AlphaGo)’의 후속작을 아시나요?

2016년 3월 13일, 대한민국 시간으로 오후 1시에 시작된 한 바둑 대국에 전 세계의 수많은 사람들의 이목이 집중되었습니다. 5시간이 넘는 치열한 공방 끝에 백이 180번째 돌을 바둑판 위에 올려놓자, 돌연 한 컴퓨터에 경고창과 함께 인류사에 길이 남을 한 줄의 메시지가 출력되었습니다.
“AlphaGo resigns”
대한민국의 최정상급 프로 바둑 기사였던 이세돌 九단과 구글의 자회사인 ‘딥마인드(Deepmind)’ 사에서 개발한 바둑 인공지능 프로그램인 ‘알파고(AlphaGo)’의 다섯 번에 걸친 대국은 전 세계인들을 놀라게 하였습니다. 이세돌 9단의 네 번의 패배는 인공지능은 아직 인간을 따라잡기에는 멀었다는 사람들의 생각을 무참히 깨부수어 충격을 안겨주었고, 인공지능도 예상하지 못한 ‘신의 한 수’를 통해 거둔 한 번의 승리는 여전히 인간이 인공지능을 앞설 수 있다는 기대감을 안겨주었습니다.
여기까지의 이야기는 바둑에 크게 관심이 없으신 분이라 하더라도, 워낙 대한민국을 떠들썩하게 만들었던 이슈인지라 한 번쯤은 들어보셨으리라 생각합니다. 그런데 이야기는 거기서 끝나지 않습니다. ‘최초의 패배’에 절치부심이라도 한 것일까요, 이 대국 이후에도 무서운 속도로 바둑 기보들을 학습하였고, 어느 날 홀연히 인터넷 바둑 프로그램에 등장하여 단 한 번의 패배도 없이 60연승이라는 경이로운 기록을 세웠습니다. 2017년 5월에는 당시 세계 최정상급 프로 바둑 기사였던 커제 九단과의 세 번의 대국에서 모두 승리를 거두었고, 같은 대회에서 중국 바둑 기사 다섯 명과의 상담기에서까지 승리를 거두었죠. 74전 73승 1패라는, 바둑사에 길이 남을 경이로운 기록을 남긴 알파고는, 74번째 대국을 마지막으로 은퇴를 선언하고는 다른 인공지능 후배들(?)에게 자리를 넘겨주었고, 2017년 12월 완전히 개발이 종료되었습니다.

"개발이 종료되었다고? 그럼 딥마인드는 그 이후로부터 지금까지 뭘 하고 있는 거지?”
아마 호기심이 많은 분들이라면 이렇게 물어보실 수도 있을 것 같습니다. 알파고 연구를 통해 머신러닝에 대한 지식과 기술을 차곡차곡 쌓은 딥마인드의 개발자들은 이후 두 가지 프로젝트에 착수하였습니다. 하나는 가히 대한민국의 전통 놀이라 할 수 있는 ‘스타크래프트’ 시리즈에서 인간과 대결을 펼칠 인공지능을 개발하는 ‘알파스타(AlphaStar)’였는데요, 2019년 10월 알파스타는 전임자인 알파고와 마찬가지로 스타크래프트2 유저들 중에서도 최고의 실력자들만이 모이는 등급인 ‘그랜드 마스터’를 달성하였지만, 어째서인지 그 후로 이렇다 할 활동이나 업데이트 소식은 들리지 않고 있습니다.
또 하나의 프로젝트는 알파스타와는 달리 꾸준히 개선이 이루어지고 있고 활동 성과도 간간이 발표되고 있는데요, 특이하게도 이 프로젝트는 바둑이나 스타크래프트와 같은 게임이 아닌 자연과학 연구에 활용하는 것을 목적으로 진행되었습니다. ‘1차원의 폴리펩타이드의 서열로부터 단백질의 3차원적인 구조를 예측하는’ 알고리즘인 ‘알파폴드(AlphaFold)’가 바로 그 주인공입니다.
▶ 내 몸 속의 기계장치

알파폴드가 정확히 어떤 일을 하는지를 이해하기 위해서는, 우선 ‘단백질’이라는 물질이 정확히 무엇인지부터 이해해야 합니다. 단백질은 탄수화물, 지방과 더불어서 사람이 생명을 유지하는 데에 필수적인 3대 영양소 중 하나입니다. 최근 건강, 혹은 뷰티에 대한 관심이 높아지면서 단백질이 근육을 구성하는 성분이라는 사실은 많은 분들이 이미 알고 계실텐데요, 사실 단백질은 근육을 형성하는 것 이외에도 우리의 몸 안에서 엄청나게 다양한 역할들을 담당하고 있습니다.

단백질은 스무 종류에 달하는 ‘아미노산(amino acid)’이라는 단량체가 ‘펩타이드 결합’을 통하여 연결되어있는 고분자입니다. 쉽게 말해서, ‘아미노산’이라는 작은 블록들이 쌓여서 만들어지는 하나의 레고 작품이라고 생각할 수 있는 것이죠. 적게는 수십 개에서 많게는 수천, 수만 개에 달하는 아미노산들이 차례대로 연결되어있는 선형의 사슬을 우리는 ‘폴리펩타이드(polypeptide)’라고 부릅니다.
이러한 폴리펩타이드들은 체내에서는 직선형으로 존재하지 않고, 사슬을 구성하고 있는 아미노산들 사이의, 또 체내의 여러 물질들과의 복잡한 상호작용을 통하여 고유한 3차원 구조로 접히게 됩니다. 이러한 과정을 과학자들은 ‘단백질 접힘(protein folding)’이라고 부릅니다.
이렇게 접힌 각각의 단백질들은 그 구조에 따라서 고유한 기능을 가집니다. 단순히 우리 몸의 어떤 부분을 구성하는 성분으로 작용하는 것 외에도 다른 물질을 운반하거나, 분해하거나, 혹은 외부에서 침입한 병원균이나 바이러스에 대항하는 데에 쓰이기도 합니다. 각각의 단백질들이 마치 하나의 정교한 기계장치처럼 우리 몸에서 여러 기능들을 담당하고 있는 것이죠. 아니, 사실상 우리 몸에서 일어나고 있는 거의 모든 일들에 단백질이 관여하고 있다고 하더라도 과장이 아닙니다.

잠시 알파폴드 얘기로 돌아가자면, 단백질이 어떤 기능을 맡을 수 있는 것은 그 특유의 정교한 3차원적 구조 덕분입니다. 반대로 말하면, 단백질의 3차원적인 구조를 분석할 수 있다면 이 단백질이 우리 몸에서 어떠한 역할을 하는지도 대략적으로 예측할 수 있다는 것이죠. 문제는, 선형의 폴리펩타이드가 3차원 구조의 단백질로 접히는 과정이 매우매우매우 복잡해서, 선형의 폴리펩타이드 서열로부터 3차원 구조를 곧바로 예측할 수 있는 어떤 일반적인 규칙을 아직도 밝혀내지 못했고 ‘단백질 접힘 문제’라는 난제로 오랜 시간 남아있었습니다.
알파폴드는 바로 이 난제를 해결하기 위한 프로젝트인데요, 기존에 존재하는 폴리펩타이드들의 서열과 단백질들의 3차원적 구조 데이터를 머신러닝을 통해 학습하여, 새로운 폴리펩타이드 서열이 주어졌을 때 그것의 3차원적 구조를 예측하는 프로그램입니다. 과학자들은 1994년부터 단백질 구조를 예측하는 기술을 평가하기 위한 ‘세계 단백질 구조 예측 대회(CASP)’라는 학술대회를 2년마다 개최해 왔는데요. 놀랍게도 알파폴드는 2018년 제13회 CASP에 처음 참가하여 기존 참가자들을 뛰어넘는 성적으로 1위를 거둔 것으로 모자라, 바로 다음 대회인 2020년 14회 CASP에서는 ‘단백질의 구조를 실제와 거의 비슷한 수준으로 예측’했을 때 받는 점수인 90점에 근접하여 오랜 난제의 돌파구를 찾은 듯 보인다는 평가를 받기도 하였습니다.
▶ 폐기물 단백질 스티커, '유비퀴틴'

앞서 말하였듯 폴리펩타이드가 단백질로 접히는 과정은 매우 복잡하고 정교하기 때문에, 때로는 체내에서 폴리펩타이드가 원하는 구조의 단백질이 아닌 다른 방식으로 접히는 경우가 존재합니다. 혹은, 제대로 접혀서 잘 작동을 하던 단백질들도 외부에서 들어온 물질이나 노화로 인해 구조가 변화하면서 기능을 잃어버리거나, 그냥 할 일을 다 했으니 더는 쓸모가 없어지는 경우도 존재하죠.
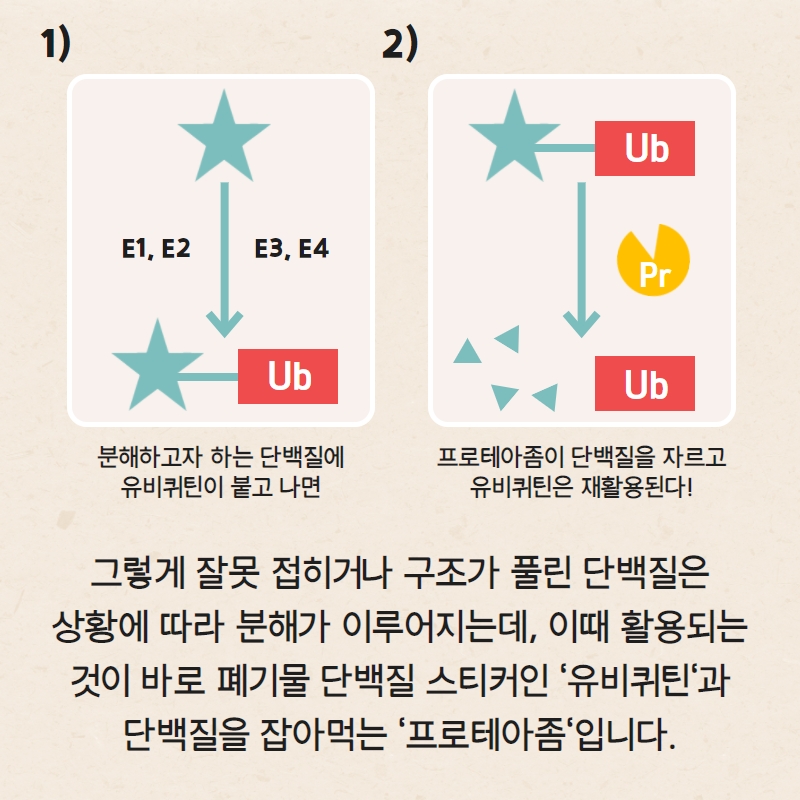
접힘 과정에서 오류가 일어났거나 불필요해진 단백질들은 두 가지 운명을 맞게 됩니다. 한 가지는 ‘샤페론(chaperone)’이라는 단백질들의 도움으로 다시 본래의 정상적인 구조로 접힐 기회를 부여받는 것이고, 다른 한 가지는 ‘폐기물'로 분류되어 처분되는 것이죠.
우리의 몸이 어떤 단백질을 폐기 처분하는 데에는 여러 방식이 사용되는데, 그 중 대표적인 것이 바로 ‘유비퀴틴화(ubiquitination)’입니다.
유비퀴틴화는 ‘유비퀴틴(ubiquitin)’이라는 단백질을 분해하고자 하는 단백질에 붙이는 과정을 의미합니다. 유비퀴틴은 거의 모든 진핵생물에서 발견되는, 아미노산 76개로 이루어진 아주 작은 단백질입니다. 이 단백질은 다른 단백질들의 도움을 받아서, 분해 작용의 희생양인 단백질에 꼬리표처럼 줄줄이 달라붙어요. 마치 우리가 버리고 싶은 대형 폐기물에 폐기물 스티커를 부착하듯이 말이죠. 이렇게 ‘폐기물 스티커’가 붙은 단백질은 ‘프로테아좀(proteasome)’이라는, 단백질을 분해하는 역할을 하는 또 다른 거대한 단백질 기계에 의해서 분해가 이루어집니다. 그리고 분해가 이루어지고 나면, 우리가 쓰는 끈적한 폐기물 스티커와는 달리 유비퀴틴은 다시 원상 복구되어서 또 다른 단백질과의 “죽음의 입맞춤(kiss of death)”을 하는 데에 재활용됩니다.
이처럼 단백질이 단백질을 단백질에 붙이고, 단백질이 붙은 단백질을 단백질이 분해하는, 단백질 천국의 '유비퀴틴-프로테아좀 경로(ubiquitin-proteasome pathway, UPP)'는 이스라엘의 생화학자인 아론 치카노베르 교수와 아브람 헤르슈코 교수, 그리고 미국의 생물학자인 어윈 로즈 교수에 의해 명확히 밝혀졌는데요, 이 세 과학자는 그 공로로 2004년 노벨화학상을 수상하였습니다.
▶ 잘못 만들어진 기계는 때로 흉기가 된다
동서고금을 막론하고, 오류가 발생한 기계가 인간을 돕기는커녕 해치는 일이 이따금씩 발생하곤 합니다.
앞에서도 말했지만, 여러 다른 기계들과 마찬가지로, 우리 몸 속의 기계인 단백질들 역시 오류가 발생할 수 있습니다. 그런데 이렇게 이상이 생긴 단백질이 단순히 기능을 멈추는 수준에만 머무른다면 정말 다행이지만, 문제는 그보다 더 심각합니다. 비정상적인 단백질들은 우리 몸에서 여러 질병을 일으키는 원인이 되기도 하거든요.
대표적인 예시가 바로 ‘알츠하이머병’입니다. 알츠하이머병은 흔히 ‘치매’라고 불리는 질환으로, 뇌의 세포들이 죽으면서 뇌의 기능이 점점 퇴행하는 질환입니다. 드라마 《나빌레라》의 주인공으로 김인환 씨가 분했던 ‘심덕출’과 《눈이 부시게》의 주인공 김혜자 씨가 앓고 있던 질병이죠.
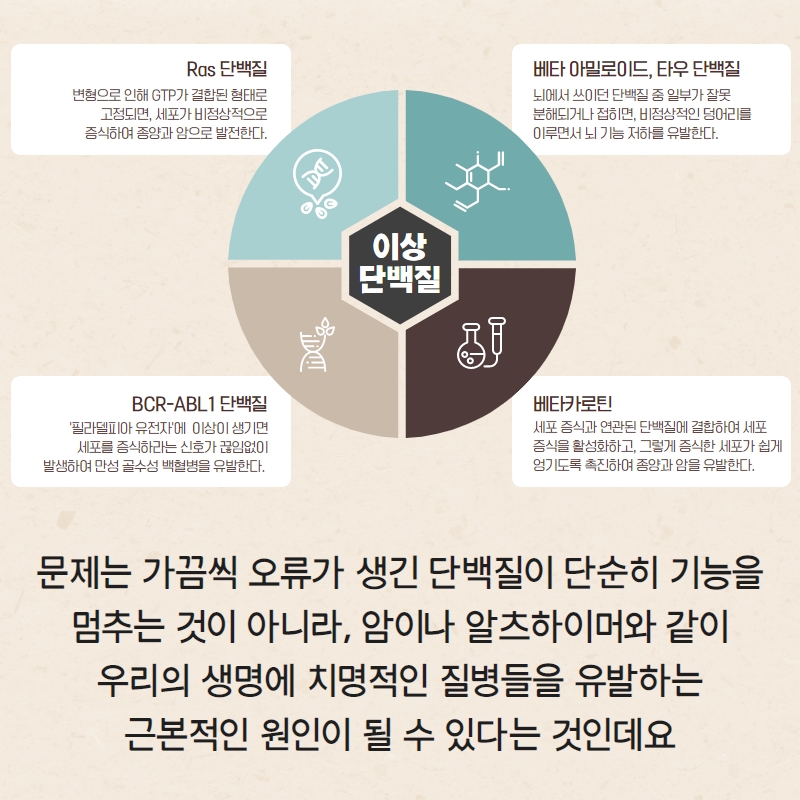
알츠하이머 발병의 정확한 기작은 아직 밝혀지지 않았지만, ‘β(베타)-아밀로이드(beta-amyloid)’라는 단백질과 ‘τ(타우)-단백질(tau protein)’이 가장 유력한 원인 물질로 꼽히고 있습니다.
우리의 뇌에는 다른 기관들과 마찬가지로 다양한 단백질이 존재하는데요, 그중에서도 인간의 신경 세포인 ‘뉴런(neuron)’에는 ‘아밀로이드 전구체 단백질(amyloid precursor protein, APP)’라는 단백질들이 매우 많이 분포되어 중요한 기능을 담당하고 있습니다. 그런데 이 단백질들이 수명이 다하면 분해가 되면서 β-아밀로이드라는 더 작은 단백질을 형성하는데요, 이 β-아밀로이드 중 일부가 자기들끼리 뭉쳐서 덩어리를 형성하여 뇌에 남게 되면, 뇌의 기능을 저하시키는 독성을 유발한다는 것이 바로 ‘β-아밀로이드 가설’입니다.
한편 뇌에는 APP 외에도 뉴런의 영양분 공급에 관여하는 ‘τ 단백질’ 역시 존재하는데요. 타우 단백질 역시 일차원의 폴리펩타이드 사슬이 접히면서 3차원 구조를 얻게 되는데, 이 과정에서 오류가 발생하면 본래의 3차원 구조 대신에 거의 직선형에 가까운, 섬유와 같은 구조의 단백질이 얻어집니다. 이 섬유 단백질들이 또다시 자기들끼리 켜켜이 얽히면서 뇌에서의 신경 전달 과정을 방해하는 큰 덩어리를 형성하여 뇌 기능이 저하된다는 것이 바로 ‘타우 단백질 가설’ 혹은 ‘신경섬유 다발(neurofibrillary tangle) 가설’입니다.
▶ 프로탁, 암과 맞설 새로운 무기가 되다

암이란 무엇일까요? 암은 그 종류가 매우 다양하지만, 근본적으로는 우리 몸을 구성하고 있는 레고블록인 세포가 비정상적으로 많이 성장하면서 우리 몸의 기능을 망가뜨리는 병이라고 할 수 있습니다. 이렇게 비정상적으로 자라서 뭉쳐있는 세포 덩어리들을 우리는 ‘종양’이라고 부르죠.
몇몇 암은 치매와 마찬가지로 비정상적인 단백질이 문제가 되어 발병합니다. ‘만성 골수성 백혈병(chronic meyloid leukemia)’이 그 대표적인 예시입니다. 우리 몸에는 스위치가 켜졌다가 꺼지듯이, 상황에 따라 활성화와 비활성화를 반복하면서 세포의 성장을 조절하는 단백질들이 존재하는데요. ‘필라델피아 염색체(Philadelphia chromosome)’라고 불리는 유전자에 돌연변이가 생기면, ‘BCR-ABL1’이라는 변형된 단백질이 꺼져야 할 때도 꺼지지 않고 온종일 켜진 상태로 남아있으면서 거의 무한정으로 세포를 복제시킵니다. 그렇게 쌓이는 세포들이 뭉쳐져, 종양이 되고 암으로 발전하는 것이죠.
‘Ras 단백질’과 ‘베타카테닌(β-catenin)’ 역시도 암과 밀접한 관련이 있는 단백질들로 알려져 있습니다. Ras 단백질 역시 본래의 멀쩡한 상태라면 활성화와 비활성화를 반복하면서 세포의 증식이 일정한 주기로 일어나도록 조절하는 역할을 담당합니다. 그런데 이 단백질에 무언가 이상이 생겨서, Ras 단백질에 GTP라는 물질이 붙어버린 상태로 고정이 되면, 이 단백질이 끊임없이 우리 몸의 세포에게 증식을 일으키라는 신호를 보내게 됩니다. 베타카테닌은 대장암 환자들에게서 많이 발견되는 단백질인데요, 연구에 따르면 이 단백질은 세포의 증식과 연관된 단백질에 결합하여 세포 증식을 활성화시키는 것은 물론이고, 그렇게 형성된 세포들이 서로 떨어지지 않고 쉽게 엉겨붙도록 촉진한다고 합니다.
이런 문제의 단백질들을 우리 몸이 제때 분해해 줄 수 만 있다면 걱정이 없겠지만, 노화가 이루어지면서 이러한 단백질들을 분해하는 시스템이 점차 제대로 작동하지 않거나, 혹은 아예 사라져버리는 경우가 존재합니다. 나이가 들수록 이러한 질병에 걸릴 확률이 높아지는 것도 이러한 이유 때문이죠.
과학자들은 치매나 급성 백혈병과 같이 발병의 원인이 비정상적인 구조의 단백질이라고 생각되는 경우, 그러한 단백질들을 분해할 수 있도록 돕는다면 질병을 치료하는 길이 열리지 않을까 고민하기 시작했습니다. 그러한 고민의 결과로 최근 활발히 연구되고 있는 것이 바로 ‘프로탁(Proteolysis-Targeting Chimera, PROTAC)’입니다.
프로탁은 정확히 어떤 한 물질을 가리키는 것이 아니라 원래대로라면 우리 몸에 분해되지 않는, 혹은 분해할 수 없는 단백질에 폐기물 스티커 단백질인 유비퀴틴을 붙이도록 유도하는 단백질 기계입니다.
이 기계는 ① ‘표적 단백질’이라고 불리는, 분해하고자 하는 단백질과 결합되는 부분과 ② 표적 단백질에 유비퀴틴을 붙이는 데에 관여하는 ‘E3’라는 단백질에 결합하는 부분, 그리고 ③ ①과 ②를 이어주는 골격 부분으로 구성되어 있습니다.
프로탁 약물이 우리 몸에 들어오면, 표적 단백질에 프로탁의 ①번 부분이 먼저 결합합니다. 그 후에 표적 단백질-프로탁 덩어리 쪽으로 E3 효소가 다가오면, 프로탁의 ②번 부분이 E3 효소에 결합하게 됩니다. 이렇게 한 몸이 되고 나면, 여러 단계를 걸쳐서 표적 단백질에 유비퀴틴이 달라붙게 되고, 그 다음 이 유비퀴틴을 인식한 프로테아좀에 의해 표적 단백질의 분해가 이루어집니다. 그 과정에서 프로탁은 다시 원상복구 되면서, 또다른 표적 단백질을 찾아 떠돌아 다니게 되지요. 마치 이름 그대로 그리스 로마 신화에서 항상 사냥감을 찾아 나서던 사나운 괴물, 키메라와 같이 말이죠.
약물의 재활용이 가능하다는 것은 프로탁의 큰 장점 중 하나인데요, 기존의 약물들에 비해 보다 적은 양을 투여하더라도 효과를 볼 수가 있습니다.
또한 기존에 화학치료에 쓰이던 약물들은 이상 단백질로 인한 암의 발병 기전을 정확히 파악하여 이상 단백질의 기능에 핵심적인 부분을 약물로 막아버리는 방식을 사용하는데요, 이는 거꾸로 말하면 약물로 정확히 어느 부분을 막아야 하는지가 밝혀져 있는 단백질에 대한 약물만 제조가 가능했음을 의미합니다. 하지만 프로탁 약물은 단백질의 기능을 막는 것이 아니라 단백질을 분해할 수 있도록 유비퀴틴을 붙이는 것이 목적이기 때문에, 보다 넓은 범위의 이상 단백질들과 결합할 수 있고 더 많은 질병들을 치료할 수 있는 가능성이 열린다고 해요.
이외에도 프로탁 약물은 체내에서 제거될 경우 거꾸로 표적 단백질이 재생성될 수도 있기 때문에 약물의 농도를 적당히 조절하면 표적 단백질의 양도 적당히 조절이 가능하고요. 화학약물에 비해 약물 내성이 생기는 빈도가 훨씬 낮을 뿐 아니라 단백질을 직접 분해시키기 때문에 성인에게도 쉽게 활용할 수 있어 여러모로 효과적이고 혁신적인 치료제가 되어줄 것으로 기대하고 있습니다.

한국화학연구원 역시 한국생명공학연구원과의 공동 연구를 통하여, 항암치료제의 일환으로서 프로탁 고유 기술을 개발하기 위한 ‘신개념 질병 유발 단백질 분해 치료기술 플랫폼 구축연구’ 프로젝트를 진행하고 있는데요. 2021년 6월에는 국내 제약회사인 ‘동아에스티(주)’에게 프로탁 기술을 적용한 항암제의 기술이전을 실시하였고, 동아에스티 사는 이를 통하여 새로운 표적항암제 개발을 진행하겠다고 밝히기도 하였습니다.
▶ 생화학 – 분자 단위에서 생명의 비밀을 밝히다

인간을 비롯한 수많은 생명체들의 속에서는 매 순간순간마다 수없이 많은 물질들이 분해되고, 변화하며, 또 생성되고 있습니다. 우리가 먹고, 자고, 느끼는 것은 모두 그런 작은 변화들이 모여 생겨나는 결과라고 이야기합니다. 심지어 일부 과학자들은 인간의 자유의지 마저도 우리 몸 속에 흐르는 작은 물질들이 서로 상호작용하고 변화한 결과라고 이야기하기도 하죠.
생화학은 이렇듯 생명체에서 일어나는 현상들, 그리고 생명을 구성하는 성분들을 분자 단위에서 연구하는 화학의 한 분야입니다. 사실 이 생화학이라는 학문이 본격적으로 세상에 등장한 시기는 얼마 되지 않았습니다. 1953년 제임스 왓슨(James Watson)과 프랜시스 크릭(Francis Harry Compton Crick), 두 과학자가 우리 몸의 유전 물질인 DNA의 구조를 밝혀내면서 본격적으로 연구 성과가 꽃 피기 시작했거든요.
하지만 짧은 기간 동안 생화학은 눈이 부실 정도의 진보를 이룩하였습니다. 다양한 이론들이 차곡차곡 쌓여왔고, 21세기에 들어서는 수많은 생화학자들이 노벨화학상이나 노벨생리의학상을 수상할 정도의 업적을 남기고 있죠.

생명의 비밀을 분자 단위에서 밝혀냄으로써 생명을 더 잘 이해하고 더 나아가 노화와 질병, 기근과 같이 인류를 괴롭히는 문제들을 해결하기 위해 노력하는 한국화학연구원과 세계 곳곳에서 노력하고 있는 생화학자들의 노력에 많은 응원을 보내주시면 좋을 것 같습니다!!!
[참고 자료]
- 구본권, "알파스타, 어떻게 ‘스타2’ 최고수 올랐나", 한겨레, 2019년 10월 31일 수정, 2021년 7월 6일 접속, https://www.hani.co.kr/arti/science/future/915324.html
- Andrew Senior et. al. "AlphaFold: Using AI for scientific discovery", 2020년 1월 15일 수정, 2021년 7월 6일 접속, https://deepmind.com/blog/article/AlphaFold-Using-AI-for-scientific-discovery
- 박성은, "딥마인드 “50년 묵은 과제 해결했다”...알파폴드2로 코로나19 바이러스 단백질 구조 예측", AI타임즈, 2021년 1월 22일 수정, 2021년 7월 6일 접속, http://www.aitimes.com/news/articleView.html?idxno=134544
- "The Nobel Prize in Chemistry 2004", NobelPrize.org. Nobel Prize Outreach AB 2021. 2021년 7월 6일 접속. <https://www.nobelprize.org/prizes/chemistry/2004/summary/>
- "Advanced information on the Nobel Prize in Chemistry", The Royal Swedish Academy of Sciences, 6&





