한국화학연구원) 전지란 무엇일까?전지를 직접 만들어보자!

안녕하세요!
자 시작 부터 퀴즈를 내도록 하겠습니다.

위 세 사진의 공통점은 무엇일까요?
정답은...!
모두 '전지'를 사용했다는 것입니다 :)
여러분들은 '전지' 라는 단어를 들으면 어떤 것이 떠오르시나요?
아마 우리가 흔히 쓰는 건전지를 떠올리실 거에요!
전지는 일상에 흔히 쓰이는 건전지부터
자동차를 가게하는 동력이되는 전지까지
우리 일상에도 앞으로 발전될 산업에도 유용하게 쓰이는 것이 바로 이 전지입니다.
사실 전지라는 말을 들으면 뭔가 재미없는 과학지식이랑 관련되어있을 것 같구..
멀게만 느껴지구.. 이런 생각이 들 수 도 있어요
그치만 우리가 거의 매일 사용하는 스마트폰 부터 자동차까지!
전지는 생각보다 우리와 친근한 아이랍니다:)
한국화학연구원과 유튜버 '과학쿠기'님이 함께 직접 전지를 만들어보았다고 하는데요!
그 전에!
도대체 어떻게 전지는 전기를 공급할 수 있는 것인지!
과거부터 우리와 쭉 함께 해왔던 전지를
저와 함께 알아봅시다!
#1차전지
:최초의 볼타전지
먼저 1차전지에 대해 알아볼까요?
보통 건전지의 수명이 다했을 때 여러분들은 어떻게 하시나요?
그렇죠 버려야죠ㅎㅎ
건전지를 다시 되살리는게 힘들 뿐더러 핸드폰처럼 다시 충전할 수 도 없습니다.
이렇게 1차전지란 방전되었을 때 원래상태로 돌아가기 어려운 전지에요!
충전을 할 수도 없구말이죠
1차전지의 예로는 건전지(알칼리 전지), 수은전지, 리튬 1차전지, 볼타전지 등이 있어요
세계 최초의 전지 '볼타전지'
by. 알렉산드로 볼타(Alessandro Volta)
그럼 가장 대표적인 1차전지인 볼타전지에 대해 알아봅시다!
볼타전지는 '세계 최초의 전지' 라는 점에서 큰의미가 있죠
볼타전지는 아연판과 구리판을 두 극으로 사용한 간단한 전지입니다.
이탈리아의 물리학자인 볼타가 발견한 것입니다
전기가 발생한다는 것은 바로 전자가 이동한다는 증거인데요,
이 전지에서는 바로 '산화환원 반응'에 의한 전자의 이동이 핵심 원리입니다!
여기서 잠깐! 산화환원반응이 뭐죠??
산화환원 반응이란?
반응물 간의 전자의 이동으로 일어나는 반응으로
전자를 잃은 쪽을 산화되었다고 하고
전자를 얻은 쪽을 환원되었다고 합니다.
정확히 어떻게 산화환원 반응이 일어나는 것인지 ! 살펴봅시다
일단 볼타전지를 만드는 과정은 아~~주 간단 초간단합니다
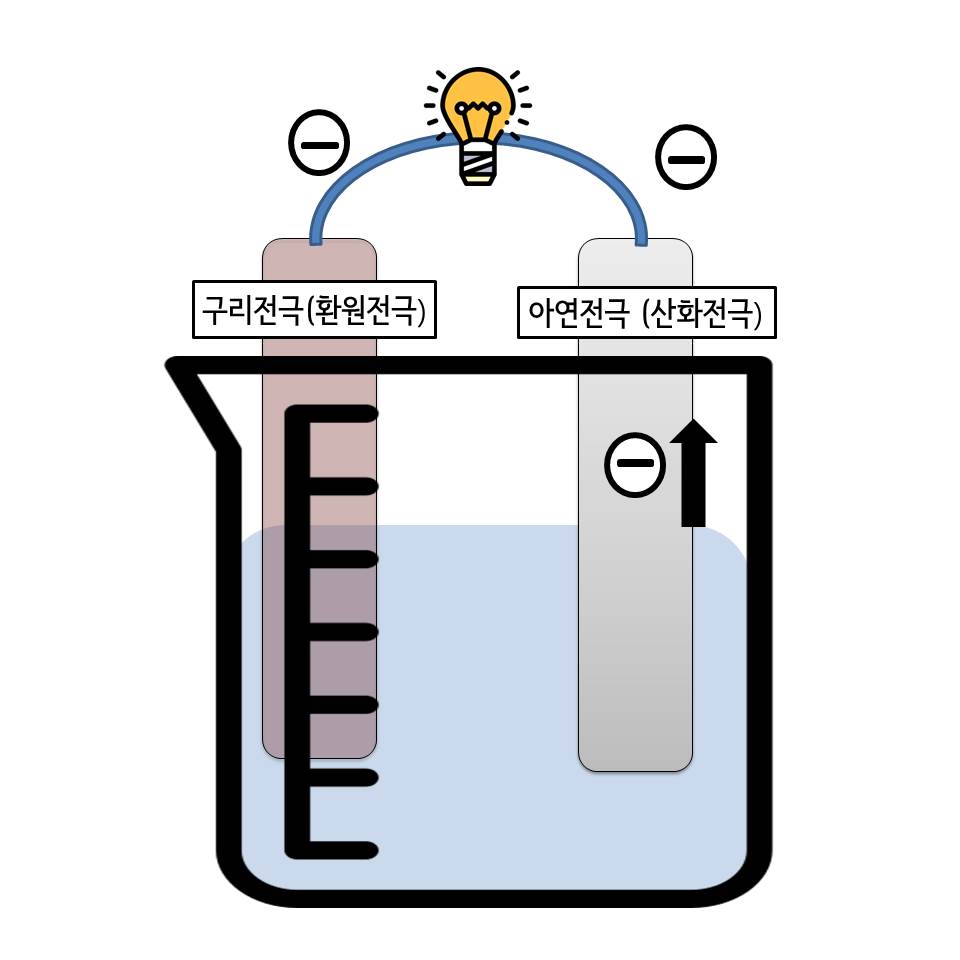
묽은 황산용액에 구리판과 아연판을 담근 후, 각각의 판을 도선으로 연결하면 끝!
이때 반응성이 큰 금속인 아연이 전자를 내어 놓게 됩니다.
이 전자는 전위차에 의하여 도선을 따라 구리판으로 이동하고
구리판에서는 용액 속의 수소이온이 전자를 얻게되어 수소기체로 환원되는 것이죠
각각의 전극에서 일어는 반응식은 다음과 같습니다
아연 전극 : Zn(s) → Zn2+(aq) + 2 e-
구리 전극 : 2 H+(aq) + 2 e- → H2(g)
즉 아연은 전자를 잃으므로 산화되었다고 말하고 아연전극을 산화전극이라고 합니다.
반대로 구리는 아연이 잃은 전자를 그대로 받아서 전자를 얻은 셈이니 당연히 환원되는 것이죠!
그래서 구리전극을 환원전극이라고 합니다.
반응식을 보니 아연전극에서 전자가 나와 구리전극으로 이동한다는 것을
명확히 알수 있겠죠?!
볼타전지에서 묽은 황산용액은 '전해질'로 사용되는데요
전해질은 물처럼 극성을 띤 용매에 녹아서 이온을 형성하여 전기를 통하게 하는 물질입니다
산화환원 반응이 일어날 수 있었던 이유는
두 전극을 이어주는 이 전해질이 있었기 때문이죠!
여기 전해질로 산성용액(묽은 황산용액)이 쓰이는 볼타전지와 달리
'알칼리성(염기성)' 용액이 전해질로 사용되는 또다른 1차전지가 있습니다!
그것은 바로 건전지!
알칼리성 용액을 전해질로 사용해서 알칼리 전지라고도 불립니다
앞서 설명드린 볼타전지와 건전지의 다른점은 단지 전해질의 pH입니다
볼타전지는 수소가 모두 사라지면 수명이 다하는 반면
건전지는 수산화이온수가 보존되어
전극의 금속이 전부 산화되기 전까지는 계속 기능을 수행합니다!
즉 볼타전지보다는 수명이 길다는 장점이 있겠죠??
하.지.만.
건전지도 일회성인것은 마찬가지인 사실....☆
이런 일회성이라는 단점을 보완할 전지가 있죠
그것이 바로 2차전지!
#2차 전지
:충전이 가능한 전지
아까 1차전지가 충전이 불가능한 전지라고 말씀드렸던 것을 기억하시나요?
2차전지는 1차전지와 달리 충전이 가능한 전지입니다!
외부로부터 전기에너지를 공급해주면
전지를 사용하기 전 상태로 돌릴 수 있는 전지입니다.
즉 '충전식 배터리'인 것입니다!
2차 전지의 경우 일반적으로는 일회용 배터리보다 초기 비용이 많이 들지만
교체하기 전 여러 번 충전 할 수 있어서 총 소요 비용과 환경 영향이 훨씬 적은 것이 장점입니다.
2차전지는 개발목적이나 용도에 따라 여러 종류와 이름으로 분류되는데
대표적으로 주로 자동차에 쓰이는 납축전지
라디오에 주로사용 되었던 형태인 니켈카드뮴전지
스마트폰이나 노트북에 이용되는 리튬이온전지 등이 있습니다.
'과학쿠키'님이 한국화학연구원에서
2차전지에 대해 알아보기 위해
산화,환원 반응이 일어나는 각 부분인 반쪽전지를 만들어보았다고 합니다!
그 과정을 유튜브영상으로 담았다고 하니
같이 보러 가실까요~~?
본 포스팅 블로그 주소: https://blog.naver.com/yjo301/221959805913